Verständnis der Virusstruktur zur Entwicklung von Medikamenten nutzen
Je besser das Verständnis der Struktur des neuen Coronavirus SARS-CoV-2 wird, umso besser stehen auch die Chancen auf die Entwicklung wirksamer medikamentöser Behandlungsmöglichkeiten. Grundlagenforschung zu der Struktur des Virus ist daher von besonderer Bedeutung. Geleistet wird diese beispielsweise an verschiedenen Max-Planck-Instituten, wo die Oberflächenstrukturen von Sars-CoV-2, aber auch die Prozesse, mit denen sich das Virus in der infizierten Zelle vermehrt, im Detail untersucht werden. Mehrere wichtige Erkenntnisse konnten so bereits gewonnen werden.
Seit Beginn der Pandemie wird weltweit mit Hochdruck daran gearbeitet, Sars-CoV-2 genau zu charakterisieren, denn „wenn man im Detail versteht, wie das Virus aufgebaut ist und sich vermehrt, können Angriffspunkte für wirksame antivirale Medikamente und Impfstoffe gefunden werden“, erläutert die Max-Planck-Gesellschaft in einer aktuellen Pressemitteilung. An verschiedenen Max-Planck-Instituten werde die Struktur von Proteinen des Virus bis auf die atomare Ebene erforscht, um das Verständnis des Erregers zu verbessern.
Bisher keine wirksamen Medikamente verfügbar
Zwar gibt es bereits wirksame Impfstoffe gegen SARS-CoV-2, aber rund ein Jahr nach Ausbruch der Pandemie steht immer noch kein wirksames Medikament zur Behandlung von COVID-19 zur Verfügung. „Antivirale Medikamente, die bei anderen Infektionen eingesetzt werden, wirken hier nicht oder nur unzureichend,“ berichtet die Max-Planck-Gesellschaft. Zudem beeinflusse schon die kleinste Abweichung in Aufbau und Funktionsweise der Viren die Wirksamkeit von Medikamenten erheblich.
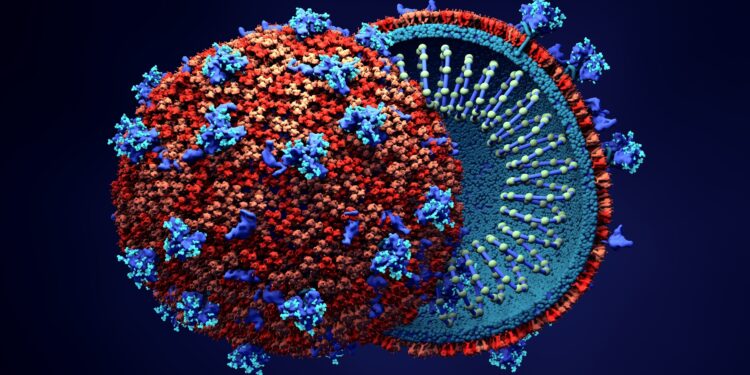
Spike-Protein untersucht
Ein wesentliches Merkmal des neuen Coronavirus ist das sogenannte Spike-Protein, welches dem Virus hilft, menschliche Zellen zu infizieren. „Dabei bindet das Spike-Protein an den ACE2-Rezeptor menschlicher Zellen, worauf das Virus mit der Zellmembran verschmilzt und sein Erbgut in das Zellinnere entlässt“, erläutert die Max-Planck-Gesellschaft. Die Struktur des Spike-Proteins hat das Forschungsteam um Martin Beck und Gerhard Hummer vom Max-Planck-Institut für Biophysik in Frankfurt detailliert untersucht.
Mithilfe von Kryo-Elektronenmikroskopie haben die Forschenden die Struktur des Proteins in fast-atomarer Auflösung entschlüsselt und auf Grundlage dieser Strukturdaten in Computersimulationen die Eigenschaften des Spike-Proteins in seiner natürlichen Umgebung analysiert, so die Mitteilung der Max-Planck-Gesellschaft. Dies habe zu überraschenden Erkenntnissen geführt. Beispielsweise sei der Stiel, mit dem das Protein auf der Virusoberfläche verankert ist, unvermutet flexibel. „Diese Beweglichkeit braucht das Protein wahrscheinlich, um in der optimalen Position an den Rezeptor auf der Zielzelle binden zu können“, erklärt Hummer.
Angriffspunkte für Vakzine oder therapeutische Antikörper
Des Weiteren habe sich in den Analysen gezeigt, dass an den oberen Teil des Spike-Proteins Antikörper gut binden können, während andere Stellen des Proteins durch Zuckerketten vor der Erkennung durch das Immunsystem geschützt sind. Die exponierte Lage des Spike-Proteins auf der Virusoberfläche mache es grundsätzlich zu einem wichtigen Angriffspunkt des Immunsystems und das Protein stehe auch im Fokus der Entwicklung von Impfstoffen und antiviralen Therapeutika. Mit dem gewonnen Wissen lassen sich nun gezielt Bereiche identifizieren, die Angriffspunkte für Vakzine oder therapeutische Antikörper sein können, betont Gerhard Hummer.
Vermehrung des Virus untersucht
Weiterhin hat das Forschungsteam um Patrick Cramer vom Max-Planck-Institut für biophysikalische Chemie die Vermehrung des Virus in der Zelle untersucht. Laut Mitteilung der Max-Planck-Gesellschaft hat Cramer langjährige Erfahrung mit der Untersuchung von RNA-Polymerasen, den „Kopiermaschinen“ des Erbguts. Und „nach Ausbruch der Pandemie hat sich eine einmalige Dynamik entwickelt, innerhalb kürzester Zeit molekulare Details sichtbar zu machen“, betont Cramer.
Erste Untersuchungen zu Wirkstoffen
In Rekordzeit sei die Struktur der RNA-Polymerase von Sars-CoV-2 ermittelt worden und die genaue Kenntnis der Sars-CoV-2-Polymerase ermögliche nun, deren Interaktion mit antiviralen Wirkstoffen im Detail zu untersuchen. Dies ist beispielsweise für das Medikament Remdesivir bereits erfolgt, das bisher als einziges Medikament in der EU zur Behandlung von COVID-19 zugelassen ist. In der Untersuchung wurde deutlich, warum Remdesivir die Vermehrung von SARS-CoV-2 nicht vollständig unterbinden kann.
„Cramer und Kollegen konnten zeigen, dass Remdesivir, das in den RNA-Strang eingebaut wird, das Weiterlaufen der RNA-Polymerase hemmt. Allerdings ist die Hemmung nicht dauerhaft, wodurch Remdesivir die Vermehrung des Virus nur verlangsamen, aber nicht völlig stoppen kann“, berichtet die Max-Planck-Gesellschaft.
Weitere Wirkstoffkandidaten identifizieren
In einem nächsten Schritt planen die Forschenden nun die Interaktion der viralen Polymerase mit weiteren bekannten Medikamenten zu untersuchen. Zudem sollen in Kooperation mit dem Max-Planck-Institut für molekulare Physiologie durch das Screening einer Substanzbibliothek auch ganz neue Wirkstoffkandidaten identifiziert werden.
Um vielversprechende Ergebnisse aus der Grundlagenforschung effektiv weiterentwickeln zu können, haben die Max-Planck-Gesellschaft und Max-Planck-Innovation das Lead Discovery Center (LDC) gegründet. Das LDC soll die Finanzierungslücken zwischen Grundlagenforschung und Medikamentenentwicklung schließen, so dass aussichtsreiche Projekte nicht aufgrund fehlender Gelder scheitern, berichtet hierzu die Max Planck Gesellschaft. (fp)
Autoren- und Quelleninformationen
Dieser Text entspricht den Vorgaben der ärztlichen Fachliteratur, medizinischen Leitlinien sowie aktuellen Studien und wurde von Medizinern und Medizinerinnen geprüft.
- Max-Planck-Gesellschaft: Die Struktur des Coronavirus verstehen (veröffentlicht 27.01.2021), mpg.de
Wichtiger Hinweis:
Dieser Artikel enthält nur allgemeine Hinweise und darf nicht zur Selbstdiagnose oder -behandlung verwendet werden. Er kann einen Arztbesuch nicht ersetzen.