Terlipressinhaltige Medikamente werden überprüft
Der Wirkstoff Terlipressin hat, wie die allermeisten Medikamente, verschiedene Nebenwirkungen. So ist bekannt, dass dadurch unter anderem Atemwegserkrankungen auftreten können. Es gibt aber auch Hinweise, dass terlipressinhaltige Arzneimittel mit einer deutlich intensiveren Gesundheitsgefahr und möglicherweise mit einem höheren Sterberisiko einhergehen könnten. Nun erfolgt eine Überprüfung der Sicherheit solcher Präparate.
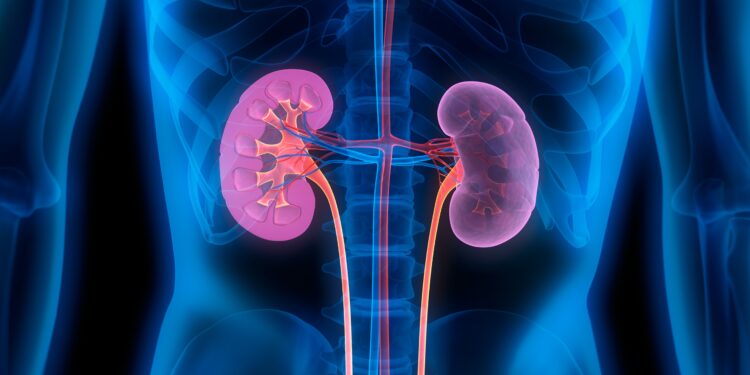
Die Europäische Arzneimittelagentur EMA hat eine Überprüfung terlipressinhaltiger Arzneimittel eingeleitet. Wie das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) in einer aktuellen Mitteilung erklärt, sind diese Arzneimittel in mehreren EU-Ländern zur Behandlung von Nierenproblemen bei Menschen mit fortgeschrittener Lebererkrankung (hepatorenales Syndrom; HRS) sowie zur Behandlung von Blutungen aus vergrößerten Venen in der Passage zwischen Mund und Magen (der Speiseröhre) und bestimmten Formen von Blutungen im Zusammenhang mit Operationen zugelassen.
Höhere Wahrscheinlichkeit für Atemwegserkrankungen
Den Angaben zufolge leitete der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) diese Überprüfung aufgrund von Sicherheitsbedenken hinsichtlich der Ergebnisse einer großen klinischen Studie an Patientinnen und Patienten mit einer Form des HRS ein, bei der sich die Nierenfunktion rasch verschlechtert.
Die Ergebnisse deuten darauf hin, dass Patientinnen und Patienten, die mit Terlipressin behandelt wurden, innerhalb von 90 Tagen nach der ersten Dosis mit höherer Wahrscheinlichkeit an Atemwegserkrankungen erkrankten und daran starben als diejenigen, die ein Placebo (ein Scheinmedikament) erhielten.
Atemwegserkrankungen, wie beispielsweise Atemversagen (schwere Atembeschwerden), sind ein bekanntes Risiko dieser Medikamente. Die Häufigkeit des Atemversagens in dieser Studie (10 Prozent) war aber höher als in der Produktinformation angegeben, in der es als gelegentlich bezeichnet wird (das heißt es betrifft bis zu 1 Prozent der Patientinnen und Patienten).
Mittel kann vorerst weiter verwendet werden
Die dänische Arzneimittelbehörde forderte aufgrund dieser Bedenken eine Überprüfung der Sicherheit terlipressinhaltiger Arzneimittel im Verhältnis zu ihrem Nutzen bei der Behandlung von HRS.
Diese Überprüfung erstreckt sich derzeit nicht auf die Verwendung von Terlipressin zur Behandlung von Blutungen, weil keine neuen Informationen über Sicherheitsbedenken für diese Indikationen bekannt geworden sind.
Solange die Überprüfung andauert, kann Terlipressin laut dem BfArM gemäß der genehmigten Produktinformation weiterhin für diese Indikationen sowie für die Behandlung von HRS verwendet werden. Nach Abschluss der Überprüfung wird die EMA die Empfehlungen des PRAC veröffentlichen.
Für die intravenöse Anwendung
Wie das BfArM erklärt, ist Terlipressin ein Vasopressinanalogon. Dies bedeutet, dass es auf die gleiche Weise wie das natürliche Hormon Vasopressin wirkt. Das Mittel verengt bestimmte Blutgefäße im Körper, insbesondere diejenigen, die die Bauchorgane versorgen.
Bei Patientinnen und Patienten mit HRS führt der erhöhte Blutdruck in der Leber aufgrund eines Leberversagens zu einer Erweiterung dieser Blutgefäße. Dadurch entsteht ein Ungleichgewicht im Blutkreislauf, welches zu einer schlechten Blutversorgung der Nieren führt.
Durch die Verengung der Blutgefäße, die die Bauchorgane versorgen, trägt Terlipressin dazu bei, den Blutfluss zu den Nieren wiederherzustellen und so auch die Nierenfunktion zu verbessern.
Terlipressin ist als Lösung sowie als Pulver zur Herstellung einer Lösung erhältlich – beides zur intravenösen Anwendung. Terlipressinhaltige Arzneimittel sind in den meisten EU-Mitgliedstaaten unter verschiedenen Namen erhältlich, darunter Glypressin®, Terlipressinacetat sowie Variquel®. (ad)
Autoren- und Quelleninformationen
Dieser Text entspricht den Vorgaben der ärztlichen Fachliteratur, medizinischen Leitlinien sowie aktuellen Studien und wurde von Medizinern und Medizinerinnen geprüft.
- Bundesinstitut für Arzneimittel und Medizinprodukte: Terlipressinhaltige Arzneimittel: Überprüfung der Sicherheit, (Abruf: 15.01.2022), Bundesinstitut für Arzneimittel und Medizinprodukte
Wichtiger Hinweis:
Dieser Artikel enthält nur allgemeine Hinweise und darf nicht zur Selbstdiagnose oder -behandlung verwendet werden. Er kann einen Arztbesuch nicht ersetzen.